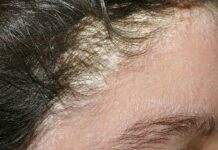
Изучение патогенеза вирусных инфекций, в том числе и герпеса, показало, что могут быть различные формы взаимодействия вируса с организмом хозяина в зависимости от продолжительности пребывания возбудителя в последнем. Во-первых, в связи с непродолжительным присутствием вируса в организме инфекционный процесс может протекать либо в острой (короткий инкубационный период с последующим развитием характерных симптомов), либо в иннаппарантной (бессимптомной) форме. Второй тип взаимодействия обусловлен длительной персистенцией вируса в организме и проявляется тремя основными формами инфекции: латентной (бессимптомная персистенция возбудителя, при которой нарушается полный цикл репродукции вируса и он находится в клетках хозяина в виде субвирусных структур; считают, что может происходить репродукция зрелого вируса, с выделением его во внешнюю среду) (Зуев В. А., 1988) либо хронической (персистенция вируса манифестируется клинической симптоматикой заболевания в течение длительного времени). Возможно развитие медленной вирусной инфекции, которая характеризуется длительным (месяцы и годы) инкубационным периодом с последующим медленным прогредиентным течением, с развитием тяжелых клинических симптомов и смерти больного. При этом необходимо иметь в виду, что формы с кратковременным и длительным (персистенция) пребыванием вируса в организме нередко связаны между собой — одна форма инфекции переходит в другую (Зуев В. А., 1988).
Репродукция герпесвирусов в чувствительных клетках — сложный процесс, протекающий с участием многих вирионных, клеточных, вирусиндуцированных и вирусмодифицированных энзимов. На поверхности вириона представлены 11 белков, 10 из которых гликозилированы (gB-gM). Гликопротеины gB, gD и gE взаимодействуют с молекулами рецепторов на наружной мембране клеток-мишеней. После слияния вирусной и клеточной мембран в цитоплазму высвобождаются белки тегумента, содержащиеся между наружной вирусной оболочкой и капсидом. Один из них, VHS, подавляет трансляцию клеточных белков, другой, ot-TNF, проникает в ядро и инициирует транскрипцию ранних (а) генов ВПГ. Капсиды транспортируются к ядерным порам, где вирусная ДНК (вДНК) высвобождается из капсидов, проникает в ядро и замыкается в кольцо. Белки — продукты трансляции а-генов ВПГ — проникают обратно в ядро и индуцируют синтез белков Р-генов (вирусспецифическая ДНК-полимераза и тимидинкиназа, необходимые для биосинтеза ДНК ВПГ). На этой стадии хроматин деградирует и распределяется вдоль внутренней поверхности ядерной мембраны. Ядрышки распадаются: у-цикл репликации приводит к синтезу структурных белков вирионов (играют важную роль в иммунопатогенезе ГИ) и образованию пустых капсидов, в которые упаковывается вДНК. Такие капсиды покрываются рецепторным белком. Вирусные гликопротеины и белки тегумента накапливаются в клетке и образуют «выпячивания» на клеточных мембранах. Капсиды, содержащие ДНК и дополнительные белки, прикрепляются к «выпячиваниям» и покрываются оболочкой. Сформировавшиеся вирионы аккумулируются в эндоплазматические ретикулумы и транспортируются во внеклеточное пространство (Mettenleiter Т. С, 2002).
Основными этапами развития герпетической инфекции являются: первичная инфекция кожи и слизистых, «колонизация» и острая инфекция ганглиев с последующим установлением латентности, когда только вирусная ДНК, находящаяся в ядрах нейронов, свидетельствует о наличии инфекции. По окончании острой фазы инфекции свободный вирус простого герпеса (ВПГ) более не обнаруживается в чувствительном ганглии. Механизмы, определяющие переход из острой фазы инфекции, когда вирус не удается обнаружить в гомогенатах ганглия, пока не выяснены. Этот переход параллелен развитию иммунных факторов: иммунная реакция хозяина уменьшает размножение вируса в коже, снимает сигнал и клетки ганглия становятся непермиссивными — устанавливается латентная инфекция.
Обнаружение вируса герпеса в ганглиях людей, перенесших в прошлом инфекцию ВПГ, говорит о реактивации инфекции, которая может протекать как бессимптомно, так и с развитием поражений слизистых и кожи.
У людей бессимптомное течение, так же как и клинически выраженный рецидив, наблюдается после микронейрохирургического вмешательства на тройничном нерве. Реактивация ВПГ часто встречается у лиц, получающих иммунодепрессанты (такие, как циклофосфамид), например, после трансплантации органов или при УФ-облучении. Активизирующий эффект перечисленных и ряда других факторов неразрывно связан с нарушением содержания в клетке циклоаденозинмонофосфата (цАМФ), роль которого велика в реализации разнообразных внутриклеточных процессов. В инфицированной ВПГ клетке резко снижается количество цАМФ. Нарушение равновесия между клеткой и ВПГ под влиянием провоцирующих факторов приводит к усилению репликации вируса, что клинически проявляется обострением (Ярославский В. К. и др., 1996).
Известны две альтернативные теории (гипотезы), предложенные для объяснения механизмов персистенции простого герпеса, которые допускают развитие рецидивов на основе статического либо динамического состояния вируса. Согласно статической гипотезе, вирус герпеса находится в клетках паравертебрального сенсорного ганглия в интегрированном или свободном непродуктивном состоянии. Под влиянием «пускового фактора» вирус активируется и перемещается из ганглия по аксону периферического нерва в эпителиальные клетки, где реплицируется. Предполагается, что этому во многом способствуют восприимчивость клеток и ослабление иммунологического контроля.
Динамическая гипотеза предусматривает постоянную репликацию и выброс из ганглия вируса герпеса. Достигая по нерву кожи, ВПГ вызывают микрофокусы инфекции, сдерживаемые механизмами защиты, что предупреждает рецидивы или ослабляет их проявления. На развитие рецидивов оказывает влияние состояние местного иммунитета, угнетение которого способствует репликации достигшего кожи вируса.
Большое количество экспериментальных исследований на животных помогает изучить различные стороны проявления герпетической инфекции. Первичное инфицирование ВПГ вызывает латентную инфекцию спинальных и церебральных ганглиев, куда вирус попадает из входных ворот инфекции эндоневрально, периневрально, интрааксонально или по шванновским клеткам. Помимо нейрогенного пути распространения герпетической инфекции большое значение имеет гематогенный путь ее распространения в результате выраженного эритропизма ВПГ, вследствие которого происходит заражение новых клеток. Кроме того, ВПГ тесно взаимодействует с лейкоцитами и даже тромбоцитами. При этом наблюдаются грубые повреждения хромосом и большие скопления антигена ВПГ в лейкоцитах.
Становление латентной инфекции связано со структурными изменениями в вирусном геноме. Это принципиально важное положение было установлено методами рестрикционного анализа и блоттинг-гибридизации с меченными 32Р вирусными ДНК при сравнении вирионной ДНК эталонного ВПГ-1. Немаловажную роль в патогенезе ГИ играет выведение ВПГ со слюной, мочой, калом. Явление вирусурии установлено еще в 1937 году Л. А. Зильбером.
Патогенез ЦМВИ не вполне выяснен. Источником инфекции является человек, который может инфицироваться ЦМВ в различные сроки жизни. Показано, что ЦМВ поражает клетки разных органов и систем, длительно персистирует в организме и периодически выделяется во внешнюю среду. Механизм развития ЦМВИ зависит от многих факторов — в частности, имеют значение пути заражения, индивидуальные (генетические) особенности макроорганизма, состояние иммунной системы в момент инфицирования. Инфекционный процесс при цитомегалии реализуется в виде либо бессимптомной латентной инфекции, либо клинически манифестной локализованной или генерализованной формой.
Входными воротами для ЦМВ в анте- и интранатальном периоде могут быть повреждения плаценты, плодных оболочек и внешних покровов плода, дыхательные пути и пищеварительный тракт. Во время фазы вирусемии при отсутствии антител у матери (а следовательно, и у плода) передача вируса плоду осуществляется значительно легче, чем в иммунном организме ранее (до наступления беременности) инфицированной женщины.
Проникший в кровь ЦМВ репродуцируется в лейкоцитах и в клетках моноцитарно-макрофагальной системы (ММС) или персистирует в лимфоидных органах. Установлено, что проникший в клетки ММС вирус может вызвать в них абортивную инфекцию, сопровождающуюся экспрессией вирусных антигенов раннего типа и последующей блокадой поздних стадий репликации возбудителя.
В ответ на внедрение ЦМВ развивается иммунная перестройка макроорганизма. Переход латентной ЦМВИ в клинически выраженные формы обычно провоцируется какими-либо патогенетическими («ослабляющими») факторами — например, применением кортикостероидов, интеркуррентными заболеваниями, назначением цитостатиков и других иммунодепрессантов. Вирионы ЦМВ адсорбируются на клеточных мембранах и проникают в цитоплазму путем пиноцитоза или виропексиса, индуцируя цитомегалический метаморфоз клеток. Особенно высокой чувствительностью к ЦМВ, как отмечалось, обладают клетки эпителия мелких протоков слюнных желез, преимущественно околоушных.
В последние годы появились убедительные доказательства в пользу того, что при хронических вирусных инфекциях может формироваться пожизненная иммуносупрессия. Это в первую очередь относится к больным СПИДом, которые в большинстве случаев погибают от вторичных инфекций, развивающихся на фоне ВИЧ-индуцированного иммунологического дефекта. По-видимому, список вирусов, определяющих длительную иммуносупрессию, будет увеличиваться, и прежде всего за счет возбудителей, которые обладают способностью длительно персистировать в клетках иммунной системы. В полной мере сказанное относится к вирусам простого герпеса и цитомегалии. Иммунопатологические реакции при ЦМВИ весьма разнообразны и во многом определяют течение и исход инфекции.
При опоясывающем герпесе (ОГ) инфицирование вирусом реализуется воздушно-капельным путем. Проникновение вируса осуществляется путем его прикрепления к рецепторам плазматической мембраны клетки хозяина. В результате слияния с мембраной клетки вируса ОГ его оболочка и встроенные в нее белки становятся частью клеточной мембраны, а капсид, содержащий генетический материал, освобождается и проникает в цитоплазму, затем перемещается в ядро. За минуту в клетку проникает около 3000 вирусных частиц.
Размножение вирусов простого и опоясывающего герпеса происходит в полиморфноядерных лейкоцитах и моноцитах. Связь с лейкоцитами обеспечивает вирусу защиту от факторов гуморального иммунитета и создает реальные предпосылки для последующей диссеминации (Баринский И. Ф. и др., 1986). Вирус ОГ (ВОГ) обнаруживается также и в эритроцитах, в которых образуются включения.
В клинике ОГ серьезное значение имеет синдром постзостерной невралгии (ПЗН). Многие авторы указывают на постинфекционный иммуноопосредованный механизм развития ПЗН, т. е. когда уже нет прямого деструктивного воздействия ВОГ на нейроны, а патологические изменения обусловлены иммунным ответом организма. Показано, что ПЗН нечувствительна к антивирусной терапии, но хорошо купируется при использовании противогерпетических иммуноглобулинов направленного действия. Это отрицает участие вируса в генезе ПЗН и подтверждает роль иммуноопосредованных механизмов. Особенно прогностически неблагоприятным является угнетение клеточно-опосредованных иммунологических реакций, так как риск активизации ВОГ существенно возрастает. Так, в частности, показано, что чем дольше происходит нормализация Т-клеточного звена иммунитета, тем длительнее острая зостерная боль (Higa К. et al., 1992).
Реакции цитокинов на вирусные инфекции
Ранние цитокиновые реакции (РЦР) на вирусные инфекции лежат в основе естественного иммунитета (Ершов Ф. И., Киселев О. И., 2005). Классическим примером РЦР является выработка интерферонов (ИФН) сразу после инфицирования клеток. Начало внутриклеточной репродукции вирусов сопровождается не только образованием ИФН, а но и последующим разрушением вирусных геномных РНК и мРНК, связанных с действием 2′-5′-олигоаденилсинтетазы, приводящей к активации эндонуклеазы (RNA-аза L). Активированная протеинкиназа фосфорилирует а-субъединицу фактора инициации трансляции elF-2, после чего блокируется синтез вирусных белков. Вследствие этого происходит подавление репродукции широкого спектра ДНК- и РНК-содержащих вирусов в результате прямого внутриклеточного антивирусного действия. РЦР развиваются последовательно с учетом этапов вирусного инфицирования клеток.
РЦР на 1-м этапе вирусного инфицирования. а/b-ИФН (ИФН 1-го типа) активируют естественные киллеры (ЕК) и цитотоксические Т-лимфоциты (ЦТЛ). Вследствие этого на 1-м этапе вирусного инфицирования локально (во входных воротах инфекции) происходят взаимосвязанные события:
РЦР на 2-м этапе вирусного инфицирования. В части случаев бывает достаточно этих местных реакций для предотвращения дальнейшего развития инфекции (Вершинина М. Ю. и др., 2002). Однако при массивном заражении, пониженной иммунобиологической резистентности, ИФН-дефиците, действии других неблагоприятных факторов (экология, стрессы, хронические заболевания и др.) развивается острая или хроническая инфекция, что сопровождается продукцией каскада ранних цитокинов, активацией CD4+ и CD8+ Т-лимфоцитов с последующим развитием Т- и В-опосредованного иммунного ответа. При этом помимо а/b-ИФН синтезируются другие ранние цитокины — ФНО и у-ИФН (ИФН 2-го типа), образуются ИЛ-1, ИЛ-6, ИЛ-10, ИЛ-15, ИЛ-18, а также трансформирующий фактор роста (ТФР). При возможной вариабельности РЦР с учетом вида вирусов неизменно синтезируются а/b-ИФН, что рассматривается как характерный признак вирусного инфицирования (Biron С. А., 2001).
Следует отметить, что а/b-ИФН дают ряд т. н. непротивовирусных эффектов: лейкопению, лимфаденопатию, миграцию ядросодержащих клеток из красной пульпы в белую пульпу селезенки, т. е. происходит перераспределение клеток для последующих иммунорегуляторных эффектов. Указанные выше цитокины продуцируются моноцитами/макрофагами, ЕК, полиморфноядерными лейкоцитами, клетками различных органов и тканей (табл. 3).
Таблица 3. Ранние цитокины, формирующиеся в ответ на вирусное инфицирование (Ершов Ф. И., Киселев О. И., 2005)
| Вирусы | Цитокиновый ответ |
| Лимфоцитарного хориоменингита | а/b-ИФН |
| Простого герпеса 1-го типа (ВПГ-1) | а/b-ИФН, у-ИФН.ИЛ-га, ИЛ-12, ФИО |
| Гриппа | а/b-ИФН, Y-ИФН, ИЛ-12, ИЛ-18, ФНО |
| Респираторно-синтициальный | Y-ИФН, ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10 |
К цитокинам с прямым противовирусным действием относятся а/b-ИФН и ФНО, которые продуцируются ЕК-клетками. ФНО усиливает зависимую от ИЛ-12 продукцию у-ИФН (Воуег N. et al., 2000). Эффекторные механизмы 2-го этапа РЦР (Ершов Ф. И., Киселев О. И., 2005):
- продукция а/b-ИФН;
- активация ЕК и ЦТЛ-клеток;
- продукция у-ИФН;
- перераспределение лимфоцитов;
- экспрессия генов ИЛ-1, ФНО;
- каскадная активация продукции других цитокинов.
Эти механизмы активации врожденного иммунитета в ответ на вирусную инфекцию кардинально отличаются от реакций организма на другие патогены. ФНО и y-ИФН активируют макрофаги, которые участвуют в противовирусной защите (Покровский В. И. и др., 2003). При прогрессировании вирусной инфекции происходит регуляция генов, отвечающих за синтез ИЛ-12, что прямо связано с продукцией у-ИФН.
Если инфекционный процесс развивается дальше, то продолжается активация неспецифических компонентов иммунной системы — экспрессия генов рецепторов цитокинов, перераспределение иммуно-компетентных клеток, увеличение цитолитической активности ЦТЛ и продукции у-ИФН, индукция пролиферации ЕК и CD8 Т-клеток памяти (Садыков А. С. и др., 1988; Вершинина М. Ю. и др., 2002). Таким образом, система ИФН осуществляет не только первую линию защиты организма от инфекций (когда иммунная система еще не успевает отреагировать), но и участвует в дальнейших (уже иммунных) процессах уничтожения чужеродных объектов. Если иммунная система отвечает за неизменность белкового состава организма, то система ИФН следит за поддержанием генетического гомеостаза, т. е. за сохранением постоянства состава организма на уровне генома (Ершов Ф. И., 1996).
Таблица 4. Антивирусная активность и регуляция активности цитокинов ИФН и его индукторами (Ершов Ф. И., Киселев О. И., 2005)
| Индуктор | Антивирусный спектр эффективности |
Индукция мРНК цитокинов | Подавление мРНК цитокинов |
| а-ИФН | Грипп и другие ОРВИ, герпес, вирусные гепатиты | ИЛ-2, ИЛ-4, ИЛ-8 | у-ИФН, ИЛ-4, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-18,ФНО |
| Кагоцел | Грипп и другие ОРВИ, герпес | а-ИФН, у-ИФН, ИЛ-2 | α-ИФН, γ-ИФН, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-18 |
| Циклоферон | Грипп и другие ОРВИ, герпес, вирусные гепатиты, ВИЧ-инфекция | у-ИФН, ИЛ-2, ИЛ-4, ИЛ-8.ИЛ-10 | у-ИФН, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12 |
Антивирусное действие индукторов ИФН (циклоферона) реализуется через механизмы активации ими цитокинов, подавляемых при вирусном инфицировании (Васильева И. А. и др., 2003; Вершинина М. Ю. и др., 2002; Садыков А. С. и др., 1988). Считают, что способность «запрещать выключение» цитокинов при вирусных инфекциях может стать методом отбора новых антивирусных препаратов.
Индукцию или супрессию цитокиновых мРНК можно получить в зависимости от типа использованных клеток и вида препарата, что может отражать различия механизмов их противовирусного действия (табл. 4). Выявленные различия могут быть использованы для регуляции активности различных цитокинов индукцией/супрессией цитокиновых сигналов, которые направлены на предотвращение инфекции или нивелирование иммунодефицитных состояний (Ершов Ф. И., Киселев О. И., 2005).
Таким образом, РЦР непосредственно связана с противовирусными эффектами цитокинов. Они могут реализоваться на уровне инфицированных клеток и/или активировать неспецифический клеточный иммунитет, при этом конечным этапом РЦР является участие в специфическом иммунном ответе (Biron С. А., 2001, 2002).
Как указывалось выше, большое значение в противовирусной защите организма придается системе интерферонов (ИФН). Для хронических вирусных инфекций (герпес, гепатит В), а также заболеваний невирусной природы характерно выраженное подавление интерфероногенеза. При этом более значительно продукция ИФН подавлена у больных с тяжелым течением хронического заболевания. Фоновые показатели сывороточного ИФН сочетаются с резко угнетенной способностью иммуноцитов синтезировать ИФНа и ИФНу.
Динамика развития противовирусной защиты
Показано, что ИФН 1-го типа играют основную роль в местной и системной противовирусной защите. Эффективность индукторов ИФН тем выше, чем более своевременно они используются для профилактики и терапии вирусных инфекций. Разделяют несколько стадий в процессе индукции при оптимальной силе сигнала или дозе индуктора (Ершов Ф. И., Киселев О. И., 2005):
- взаимодействие индуктора с рецептором;
- накопление кластера рецепторов с лигандом;
- аккумуляция сигнала;
- активация каскада протеинкиназ;
- транслокация транскрипционного активатора в клеточное ядро;
- активация транскрипции генов, в данном случае ИФН 1-го типа;
- транскрипции гена(ов), процессинг, транспорт мРНК в цитоплазму, трансляция;
- накопление ИФН, секреция.
Установлено, что обычная индукция занимает 2-6 часов, при гриппе максимальный уровень ИФН в периферической крови достигается через 12 часов, т. е. поздно в сравнении с темпами развития гриппозной инфекции (24-48 часов) (Ершов Ф. И., 1998). Следует напомнить, что а/b-ИФН оказывают не только прямое противовирусное действие, но и запускают реакции специфического иммунитета, контролируют развитие иммунного ответа ТЫ типа и в конечном итоге обеспечивают активацию Т-клеточного противовирусного иммунитета (Biron С. А., 2001; Julkunen I. et al, 2001). В то же время важен баланс между а/b-ИФН и провоспалительными цитокинами (ИЛ-1b, ИЛ-6, ФНО-а), ибо выраженная локальная провоспалительная реакция играет важную роль в диссеминации вирусной инфекции.
Отмечено, что выраженная спонтанная продукция ИФН может показывать наличие в организме таких индукторов ИФН, как реплицирующиеся вирусы, хламидии. Следует подчеркнуть, что достаточно полную картину системы ИФН может дать только указанная комбинация показателей, так как каждый из них в отдельности не дает четкого представления о происходящих в организме процессах.
В табл. 5 приводятся возможные варианты ИФН-статуса у больных с различными формами инфекционного процесса и возможные способы терапии.
Таблица 5. Характеристика показателей системы интерферонов при различных формах вирусных инфекций (Ариненко Р. Ю., 1997; Исаков В. А., 1999)
| Форма инфекционного процесса | Сывороточный ИФН, МЕ/мл |
Продукция ИФН in vitro | Терапия | |
| ИФНа/р, ME | ИФНу, ME | |||
| Здоровые люди (норма) | 0-10 | 250-520 | 110-250 | — |
| Острая инфекция | 25 | ПО | 55 | ИФН, АО; в реконв. — инд. ИФН |
| Острая инфекция, тяжелое течение | >35 | <60 | <30 | ИФН+ПХ +СЭТ+АО |
| Хроническая инфекция, иммунодефицитные состояния, ИФН-дефицит | 12-25 | 85-250 | 45-110 | ПХ+ИМ+АО +СЭТ, затем инд. ИФН |
| Выраженная депрессия активности ИФН- и иммунной систем (рецидив хрон. инф.) | 0-10 | 40 | 20 | Заместительная ИФН-тер.+ПХ +СЭТ+АБ |
Обозначения: ИФН — интерферон; инд. ИФН — индукторы ИФН; АО — антиок-сиданты, ИМ — иммуномодуляторы, СЭТ — системная энзимотерапия, АБ — антибиотики, ПХ — противовирусные химиопрепараты.
При обследовании здоровых людей в сыворотке крови определяются очень низкие количества циркулирующего ИФН при высокой способности лейкоцитов продуцировать ИФН in vitro. Рекомендуется наряду с абсолютными значениями выражать результаты исследований в процентах от нормы. При патологических состояниях изменяется соотношение циркулирующего и индуцированного ИФН, а также способность лейкоцитов периферической крови продуцировать ИФНа/р и ИФНу. Анализируя изменения в ИФН-статусе на примере вирусных инфекций (табл. 5), следует отметить, что состояние системы ИФН отражает динамику развития заболевания.
Острая вирусная инфекция сопровождается повышением содержания общего сывороточного ИФН на фоне снижающейся способности лейкоцитов к продукции разных типов ИФН, что отражает нормальную реакцию организма на активную вирусную инфекцию. В этой ситуации применение индукторов ИФН окажется малоэффективным. Целесообразно назначение 1-2 курсов современных препаратов ИФН (например, виферона — реаферон в сочетании с антиоксидантами), а в периоде реконвалесценции показано использование индукторов ИФН (циклоферон).
Тяжелое течение инфекции характеризуется выраженным дисбалансом системы ИФН: показатели сывороточного ИФН >35 МЕ/мл при резко сниженной способности лейкоцитов к синтезу ИФНа/р (При хронической вирусной инфекции (вирусно-бактериальные, персистирующие) на фоне снижения уровня сИФН отмечается более высокая способность лейкоцитов к продукции индуцированного ИФНа/р и ИФНу по сравнению с острыми вирусными заболеваниями (табл. 5). В этих случаях рекомендуют этиотропную терапию в сочетании с ИФН и иммуномодуляторами. Повышение продукции ИФНа/р и ИФНу является показанием для применения индукторов ИФН и классических иммуномодуляторов.
В случае выраженной депрессии активности ИФН- и иммунной систем (рецидив хронической инфекции, активная репродукция вируса) можно выявить углубление дисбаланса системы ИФН: существенное снижение сИФН сочетается с резким понижением индуцированной продукции лейкоцитами ИФНа/b и ИФНу до 5-10% от уровня нормы. Система ИФН не в состоянии осуществлять свои защитные функции и реагировать адекватно на стимуляцию. Возможна генерализация инфекционного процесса. Показана заместительная ИФН-терапия, которая может предшествовать назначению антибиотиков, химиопрепаратов и энзимотерапии, в дальнейшем с ними сочетаясь.
По мнению Г. Т. Сухих с соавт. (1997), общая схема иммунного ответа на герпетическую инфекцию может быть представлена следующим образом. Иммунный ответ организма человека на вирусную инфекцию делится на две фазы — фазу локализации вируса на ограниченной анатомической площади и фазу позднего специфического воздействия, в течение которой локализованная инфекция удаляется.
В заключение данного раздела необходимо отметить, что формирование иммунитета при герпесвирусных инфекциях является сложным и многокомпонентным процессом, в ходе которого клеточная кооперация может нарушаться на различных этапах. Так, например, активность макрофагов, характер вирусной инфекции и доставка вирусспецифического антигена В-лимфоцитам на индуктивной стадии герпеса определяет резистентность организма к этой инфекции. С другой стороны, решающее влияние на ГИ оказывает специфический клеточный иммунитет, опосредованный Т-лимфоцитами. Состояние клеточного иммунитета человека в значительной степени определяет характер течения ГИ, частоту и интенсивность рецидивов. От продукции В-лимфоцитами антител и от взаимодействия Т-лимфоцитов с инфицированными клетками зависит развитие и состояние приобретенного иммунитета.
Результаты иммунологического обследования больных. Известно, что при нарушениях иммунного статуса ГИ развивается чаще и характеризуется более тяжелым течением, что связано с недостаточностью иммунитета или избыточной иммунной реакцией. Механизмы иммунопатологии при ГИ разнообразны и включают как ответ на персистирующий антиген, так и неадекватную регуляцию вирусспецифического иммунного ответа. Среди иммунопатологических состояний выделяют реакции, индуцированные иммуноглобулинами, иммунопатологию, вызванную иммунными комплексами и Т-лимфоцитами. Выраженность иммунопатологического компонента при ГИ, по-видимому, можно снизить путем воздействия на отдельные звенья иммунной системы.
ДНК-вирусы типа поксвирусов, герпесвирусов и аденовирусов применяют разнообразные механизмы, позволяющие им увеличивать время эффективной репликации и распространения вирусных частиц. Кроме того, герпесвирусы дополнительно способны уклоняться от иммунной системы организма хозяина за счет индукции состояния латентности. Механизмы избегания вирусом иммунной атаки в целом могут быть разделены на три группы:
- уклонение от распознавания компонентами гуморального иммунитета, например, за счет изменения иммунодоминантных эпитопов,
- препятствование клеточному иммунитету, например, за счет подавления презентации вирусных пептидов, а также подавление активности НК клеток,
- подавление реализации эффекторных функций, например, экспрессии цитокинов, а также апоптоза инфицированных клеток.
Герпесвирусы не только персистируют, но и репродуцируются в клетках иммунной системы, обусловливая гибель или снижение функциональной активности этих клеток, что способствует развитию вторичных иммунодефицитных состояний, поддерживая длительную персистенцию. Таким образом, возникает своеобразный «порочный круг».
Исследован иммунный статус у 33 больных с ГИ, находящихся на лечении в городской инфекционной больнице г. Великого Новгорода (табл. 6, 7). Полученные данные сравнивали с показателями диспансерной группы 50 ВИЧ-инфицированных пациентов с клиническими проявлениями простого герпеса (ВИЧ+ГИ).
Таблица 6. Показатели клеточного иммунитета у больных с различными вариантами течения простого герпеса
| Показатели иммунитета | Здоровые люди (n =24), М±m |
Герпетическая инфекция (n = 33), М±m |
ВИЧ+ ГИ (n = 50), М±m |
| Число клеток крови в 1 мкл (аб.числа) | |||
| Лейкоциты х10 9 /л | 6565,9 ± 380,1 | 5215,5 ± 276,6 р < 0,001 | 4982,0 ± 243,7 р < 0,001 |
| Лимфоциты | 2792,3 ± 195,9 | 1882,0 ± 92,9 р < 0,001 | 2084,2 ± 143,2 р < 0,001 |
| CD3 | 2006,6 ± 151,8 | 1262,3 ± 69,6 р < 0,001 | 1375,9 ± 88,9 р < 0,001 |
| CD4 | 1410,8 ± 85,9 | 836,9 ± 48,3 р < 0,001 | 735,9 ± 59,8 р < 0,001 |
| CD8 | 581,9 ±58,1 | 415,6 ±29,7 р < 0,001 | 650,8 ± 64,2 р > 0,05 |
| CD16 | 355,9 ± 46,2 | 287,9 ± 20,2 р > 0,05 | 335,0 ± 34,1 р > 0,05 |
| Индекс CD4/CD8 | 2,81 ±0,19 | 2,17±0,09 р < 0,05 | 1,38±0,12 р < 0,001 |
| Фагоцитоз с латексом | 2673,3 ± 254,8 | 1972,0 ± 140,8 р < 0,05 | 1126,6 ±78,6 р < 0,001 |
Таблица 7. Показатели иммунофенотипирования у больных герпетической инфекцией
| Клетки крови | Иммунофенотипы | ГИ (n=11) | Здоровые люди (n=6) | P |
| M ± m | M ± m | |||
| WBC (лейкоциты) | L | 4960 ± 339,3 | 5860 ± 775,7 | >0,05 |
| Lym (лимфоциты) | CD45+ (high) | 1688,4 ± 155,7 | 1742 ± 142,8 | >0,05 |
| Моn (моноциты) | CD 14+ (high) | 212 ± 54,9 | 353,3 ± 116,3 | >0,05 |
| Gra (гранулоциты) | CD 14+ (low) | 2140 ± 399,2 | 2566,7 ± 987,3 | >0,05 |
| Eos (эозинофильные лейкоциты) | CD 14+ (low) + CD45+ (low) | 92,5 ± 9,98 | 166,6 ± 49,4 | >0,05 |
| Т-лимфоциты | CD5+CD20- | 695,7 ± 162,7 | 1095 ± 33,5 | <0,05 |
| В-1 лимфоциты (от всех В) | CD20+CD5+ | 38,3 ± 9,98 | 150 ± 7,0 | <0,001 |
| В-2 лимфоциты (от всех В) | CD20+CD5- | 50 ± 11,9 | 285 ± 12,3 | <0,001 |
| Активированные Т-лимфоциты (от числа CD3+) | HLA-DR+ | 152,5 ± 36,9 | 83,3 ± 8,8 | <0,05 |
| Активированные Т-лимфоциты (маркер апоптоза) | CD3+ CD95+ | 206 ± 20,9 | 625 ± 100,5 | <0,001 |
| Т-лимфоциты, несущие IL-2 рецептор (от числа CD3+) | CD25+ | 366 ± 68,8 | 112,5 ± 56,2 | <0,001 |
| Содержание средних/ больших лимфоцитов | — | 94,3 ± 13,9 | 20,6 ± 13,9 | <0,001 |
Так, общее количество лейкоцитов в группе больных ГИ и ВИЧ+ГИ снижено по сравнению с аналогичным показателем у здоровых лиц. Абсолютное количество лейкоцитов также достоверно отличается от нормы в группах больных ГИ и ВИЧ+ГИ. Количество CD3 клеток (общее число Т-лимфоцитов) повторяет закономерность изменений вышеуказанных показателей: лейкоцитов и лимфоцитов, которые больше снижены в группе ГИ. Показатели CD4 клеток, преимущественно выполняющих функцию Т-хелперов, достоверно снижены в обеих группах больных, больше в группе ВИЧ+ГИ. Так как фенотипы CD4 являются в определенной степени рецептором для связывания с ВИЧ, то они закономерно вовлекаются в патологический процесс с постепенным их разрушением и уменьшением содержания в периферической крови. А вирус герпеса, вероятно, индуцирует ВИЧ и способствует более быстрому разрушению клеток-мишеней вируса, в том числе CD4 лимфоцитов. Известно, что ГВ являются кофакторами активации и прогрессирования ВИЧ-инфекции и СПИДа (Борисова В. В., 1994; Рахманова А. Г. и др., 1997).
Содержание субпопуляции лимфоцитов CD8, представляющих преимущественно цитотоксические клетки, достоверно снижено только в группе больных с ГИ. При сочетанном течении ВИЧ и ГИ, когда присутствуют в организме два конкурирующих вируса, содержание CD8 клеток достоверно не отличается от показателей здоровых лиц (р > 0,05). Фенотипы этих клеток не являются мишенью для ВИЧ и их повышение связано не с вовлечением в патологический процесс, а с более низким содержанием других фенотипов клеток, то есть повышение CD8 клеток можно расценивать как относительное повышение. Количество CD 16 клеток, выполняющих преимущественно киллерную функцию, их принято считать естественными (натуральными) киллерами, достоверно не отличается от аналогичных показателей здоровых лиц (р > 0,05) во всех группах наблюдений. По литературным данным известно (Хаитов Р. М., Пинегин Б. В., Истамов X. И.,1995), что натуральным киллерам в основном отводится роль в противоопухолевой защите. При вирусных инфекциях, в частности при ГИ, данная субпопуляция клеток имеет определенное значение на начальном этапе развития заболевания, возможно, поэтому в наблюдаемых группах больных содержание CD 16 клеток существенно не отличается от нормы.
Важную диагностическую и прогностическую значимость при инфекциях, связанных с ВИЧ, имеет иммунорегуляторный индекс CD4/ CD8. Указанный показатель значительно снижен в группе ВИЧ+ГИ (рНекоторые показатели гуморального иммунитета отличаются от аналогичных показателей здоровых лиц. Так, содержание IgA достоверно увеличено во всех группах больных. У больных ГИ уровень IgA составил 2,23 ± 0,24 г/л белка, у пациентов ВИЧ+ГИ содержание IgA было 1,75 ±0,14 г/л белка по сравнению 1,5 ±0,05 г/л белка у здоровых лиц. Известно, что IgA является секреторным иммуноглобулином, обеспечивает местный иммунитет на уровне слизистых оболочек. Содержание циркулирующих иммунных комплексов (ЦИК) достоверно увеличено в группе пациентов с ВИЧ+ГИ (146,6 ± 6,54 опт. ед. плотности). При одновременном присутствии в организме двух вирусов замедляется элиминация ЦИК из организма, так как в освобождении организма от ЦИК принимают участие почти все клетки и цитокины иммунной системы. Выявлено понижение показателей клеточного иммунитета особенно в группе ВИЧ+ГИ, что сопровождается ослаблением иммунного ответа и накоплением ЦИК в организме. Высокие уровни ЦИК на фоне повышенных показателей IgG имеют негативное патофизиологическое значение, так как ЦИК могут откладываться на клетках эндотелия сосудов, клеточных мембранах и нарушать их целостность. Следовательно, у больных ВИЧ+ГИ в большей мере страдает неспецифическая резистентность организма, чем при моногерпетической инфекции, что является дополнительным лабораторным критерием тяжести течения инфекции. Таким образом, установлено снижение основных показателей клеточного иммунитета, особенно CD4 фенотипа лимфоцитов при ГИ и в большей степени при ВИЧ+ГИ. Отмечается увеличение содержания IgA и ЦИК.
Часть больных с ГИ обследованы высокоточным и информативным методом проточной цитометрии (табл. 7). Некоторые показатели крови достоверно отличаются от показателей здоровых лиц, другие показатели достоверно не изменяются. Так, общее количество лейкоцитов, лимфоцитов, моноцитов и гранулоцитов не отличается от показателей здоровых лиц. Тогда как число Т-лимфоцитов, несущих CD5, снижено у больных по сравнению с нормой (р Количество Т-хелперов/индукторов, несущих CD3+, CD4+, несколько ниже, чем в группе здоровых лиц, но достоверно не отличается. В пределах нормы показатели цитотоксических клеток и В-лимфоцитов зрелых субпопуляций, несущих CD19. В1- и В2-лимфоциты, несущие соответственно иммунофенотипы CD20+CD5+ и CD20+CD5-, достоверно ниже нормы. Снижение всех клеток, несущих иммунофенотипы CD20, отвечающих за синтез антител, вероятно, способствует низкому накоплению противогерпетических антител, что может быть одной из причин персистенции вирусных антигенов. Все натуральные киллеры, несущие CD 16+ CD56+, при полном отсутствии CD3- не отличаются от показателей нормы, хотя имеют тенденцию к снижению абсолютного числа. Натуральные киллеры (NK-клетки) с высоким цитотоксическим потенциалом, несущие CD8+, но при отсутствии CD3, не достоверно отличаются от нормы, имеют тенденцию к снижению. Т-клетки антителозависимой цитококсичности, несущие CD3+CD16+CD56+, недостоверно увеличиваются, хотя коэффициент t приближается к значениям близким к достоверности. Следовательно идет активация MHC-DR локуса неспецифической цитотоксичности, за что отвечает CD56, и специфической цитотоксичности, несущих CD3+CD16+. Количественное содержание активированных Т-лимфоцитов (от числа CD3+), несущих иммунофенотипы HLA-DR, снижается (р Содержание Т-лимфоцитов, несущих ИЛ-2 рецепторы (от числа CD3), иммунофенотипа CD25+ достоверно увеличено по сравнению с нормой, они отвечают за активацию и пролиферацию цитотоксических Т-лимфоцитов. Действительно, содержание СБ8-клеток, отвечающих за цитотоксичность, имеет тенденцию к увеличению. Несмотря на увеличение указанных фенотипов, функционально они не обеспечивают цитотоксичность, что, вероятно, связано с более быстрой их гибелью. Установлено снижение апоптотических иммунофенотипов CD95 среди Т-лимфоцитов, которые отвечают за активацию запрограммированной гибели клеток. Выявлено достоверное снижение СБ20-клеток, отвечающих за гуморальное звено иммунитета, поэтому нарушается нейтрализация вируса, происходит его накопление и персистенция в организме. Содержание средних/больших лимфоцитов хотя и достоверно увеличено выше нормы, но эти клетки не способны участвовать полноценно в иммунном ответе, тем более что общее содержание этих клеток значительно ниже в общей популяции лимфоцитов. И они не способны компенсировать недостаточность иммунной системы в элиминации ВПГ из организма. Таким образом, при ГВИ присутствует недостаточность как клеточного, так и гуморального звеньев иммунитета, обусловленная уменьшением продолжительности жизни клеток, а также снижением содержания некоторых фенотипов (CD20) иммуннокомпетентных клеток. Совокупность выявленных иммунологических изменений может способствовать персистенции вирусов герпеса в организме и рецидивирующему течению болезни.
Резюмируя результаты иммунологического обследования, следует отметить, что у больных герпесом снижена продукция эндогенного интерферона, активность натуральных киллеров и антителозависимая клеточная цитотоксичность, уменьшено абсолютное число и снижена активность Т-лимфоцитов (CD3+ и CD4+ клеток) и нейтрофилов, повышено количество иммунных комплексов. В условиях ослабленного иммунологического контроля не только становится невозможной полная элиминация внутриклеточно расположенного вируса, но и создаются благоприятные условия для распространения вируса от клетки по межклеточным мостикам или экстрацеллюлярным путем. Следует отметить, что выявленные нарушения в иммунном статусе сохраняются как в фазе рецидива, так и в фазе ремиссии, что необходимо учитывать при лечении больных ГИ.
]]>