Государственный институт усовершенствования врачей МО РФ, Москва
Государственный институт усовершенствования врачей МО РФ, Москва
Медицинский институт усовершенствования врачей Московского государственного университета пищевых производств, Москва, Россия, 125080
Стратегия выбора наружной терапии при микробной экземе
Журнал: Клиническая дерматология и венерология. 2017;16(3): 46-63
Соколова Т. В., Малярчук А. П., Сафонова Л. А. Стратегия выбора наружной терапии при микробной экземе. Клиническая дерматология и венерология. 2017;16(3):46-63. https://doi.org/10.17116/klinderma201716346-63
Государственный институт усовершенствования врачей МО РФ, Москва





Экземы входят в группу наиболее распространенной дерматологической патологии. Заболеваемость экземой варьирует от 6 до 15‰ (на 1000 населения) и составляет 30—40% от общего числа кожных заболеваний. Микробная экзема (МЭ) в структуре экзем занимает второе место после истинной. В настоящее время накопилось достаточно много публикаций, посвященных различным звеньям патогенеза МЭ, что позволяет совершенствовать комплекс лечебно-диагностических мероприятий. МКБ-10 не соответствует сложившейся в России традиции подразделения заболевания на клинические формы, что исключает возможность статистического учета встречаемости МЭ в нашей стране. Цель исследования — повысить знания врачей об этиопатогенезе, классификации и лечении МЭ на основе анализа и систематизации данных литературы и результатов собственных исследований по указанной проблеме. Материал и методы. Данные об этиопатогенезе, классификации и лечении МЭ базируются на изучении и анализе 57 научных статей и монографий. Доля публикаций, вышедших за последние 10 лет (2007—2016), составляет 49,1%. Применены поисковые системы Интернета Google Scholar, Сyberleninka, eLibrary, Sigla. При описании клинических случаев использованы результаты собственных наблюдений за больными и их фотографии из личного архива. Результаты. МЭ формируется под влиянием многочисленных этиопатогенетических факторов. В статье отражена роль в патогенезе заболевания состояния кожного барьера и микробиоты кожи. Приведены данные, характеризующие иммуноаллергическую концепцию МЭ на основе использования современных методов обследования больных. Показана роль дрожжеподобных грибов рода Candida spp., которые усиливают патогенный потенциал бактериальной инфекции. С учетом этих позиций отражены общие принципы выбора тактики лечения МЭ. Приведены клинические примеры эффективности лечения МЭ с использованием комбинированного топического препарата Акридерм ГК (бетаметазона дипропионат + клотримазол + гентамицин). Заключение. В патогенезе МЭ ведущая роль принадлежит иммуноаллергической концепции заболевания. Запускать процесс могут различные инфекционные агенты. При микстинфекции бактериальной и дрожжевой микрофлоры патогенное действие обеих групп возбудителей возрастает. При отсутствии эффекта от традиционных схем лечения МЭ больного следует обследовать на наличие поверхностного кандидоза кожи и слизистых оболочек. Учитывая, что в большинстве случаев МЭ протекает с поражением не более 20% кожного покрова, препаратами выбора для наружной терапии являются трехкомпонентные топические кортикостероиды. Клинические случаи из практики свидетельствуют о высокой терапевтической эффективности Акридерма ГК (бетаметазона дипропионат + клотримазол + гентамицин).
Государственный институт усовершенствования врачей МО РФ, Москва
Государственный институт усовершенствования врачей МО РФ, Москва
Медицинский институт усовершенствования врачей Московского государственного университета пищевых производств, Москва, Россия, 125080
Экземы входят в группу наиболее распространенной дерматологической патологии [1—3]. Заболеваемость экземой варьирует от 6 до 15‰ (на 1000 населения) и составляет 30—40% от общего числа кожных заболеваний [4]. Экзему одинаково часто регистрируют во всех странах мира у представителей различных рас и вне зависимости от пола больных [5]. Микробная экзема (МЭ) в структуре экзем занимает второе место после истинной и имеет долю от 12 до 27% [1, 6—8].
В настоящее время накопилось достаточно много публикаций, посвященных различным звеньям патогенеза МЭ, позволяющих совершенствовать лечебно-диагностические мероприятия. МКБ-10 не соответствует сложившейся в России традиции подразделения заболевания на клинические формы. Это не только затрудняет, но и полностью исключает возможность статистического учета встречаемости МЭ в нашей стране.
Цель исследования — повысить знания врачей об этиопатогенезе, классификации и лечении МЭ на основе анализа и систематизации данных литературы и результатов собственных исследований по указанной проблеме.
Материал и методы
Данные об этиопатогенезе, классификации и лечении МЭ базируются на основании изучения и анализа 57 научных статей и монографий. Доля публикаций, вышедших за последние 10 лет (2007—2016), составляет 49,1%. Применены поисковые системы Интернет Google Scholar, Сyber-leninka, eLibrary, Sigla. Для описания клинических случаев использованы результаты собственных наблюдений за больными и фотографии из личного архива авторов.
Результаты
Экзема — острое или хроническое аллергическое рецидивирующее воспалительное заболевание кожи, вызываемое различными экзогенными и эндогенными факторами, характеризующееся полиморфной сыпью, обусловленной серозным воспалением кожи, поливалентной сенсибилизацией и сильным зудом [9, 10].
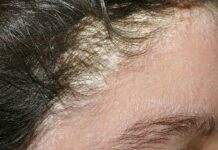
Классификация экзем. Общепринятой классификации экзем не существует. По клиническим проявлениям отечественные дерматологи различают следующие формы экзем: истинную (пруригинозную, микробную, дисгидротическую), себорейную, роговую (тилотическую), детскую и профессиональную. Разновидностями М.Э. являются монетовидная (нуммулярная или бляшечная), паратравматическая, микотическая, варикозная, сикозиформная и экзема сосков и пигментного кружка у женщин [9, 10]. В соответствии с Федеральными клиническими рекомендациями по ведению больных экземой (2016) все они, независимо от формы, шифруются как L.30 [10]. Однако в этом разделе имеются только L.30.0 — монетовидная экзема; L.30.1 — дисгидроз; L.30.2 — кожная аутосенсибилизация; L.30.3 — инфекционный дерматит; L.30.4 — эритематозная опрелость; L.30.5 — питириаз белый; L.30.8 — другой уточненный дерматит; L.30.9 — дерматит не-уточненный. Это существенно затрудняет статистический учет встречаемости различных клинических вариантов экземы. Некоторые авторы МЭ обозначают «инфекционной экземой» [11], что по МКБ-10, вероятно, соответствует инфекционному дерматиту (L.30.3). Но в патогенезе экземы и дерматита есть существенные отличия. В зависимости от длительности заболевания выделяют острую (до 3 мес), подострую (3—6 мес) и хроническую (более 6 мес) стадии заболевания [12] (рис. 1).
 Рис. 1. Стадии течения микробной экземы. а — острая; б — подострая; в — хроническая.
Рис. 1. Стадии течения микробной экземы. а — острая; б — подострая; в — хроническая.
Зарубежные авторы истинную экзему отождествляют с атопическим дерматитом (атопическая экзема), хотя эти нозологические формы имеют четкие дифференциально-диагностические критерии. К экземам также относят нуммулярную, везикулезную ладонно-подошвенную экзему и аутосенсибилизирующий дерматит [13]. Первые два варианта экзем фактически соответствуют микробной и дисгидротической экземам. Возвращаясь к традициям отечественной дерматологии, в России все научные публикации по МЭ строятся с учетом клинических форм, принятых в нашей стране.
Патогенез микробной экземы. Этиопатогенетические аспекты МЭ, по данным научных исследований, многоплановы. Однако механизмы развития иммунных отклонений в организме в целом и непосредственно в коже больных полностью не установлены, поэтому необходим комплексный подход к изучению патогенеза экземы [14—16]. Экзема, в том числе и МЭ, формируется под влиянием иммунологических, нейроэндокринных, метаболических, инфекционно-аллергических, вегетососудистых, наследственных и других факторов [9, 17—21]. Преимущественное значение тех или иных эндогенных и экзогенных влияний неоднозначно, поэтому принято считать МЭ полиэтиологическим заболеванием.
Роль кожного барьера в патогенезе микробной экземы. Неповрежденная кожа защищает организм человека от проникновения инфекционных патогенов. Это обусловлено плотным сцеплением роговых чешуек, кислой рН (4,5—5,3), жирными кислотами кожного сала, синтезом в эпидермисе некоторых интерлейкинов, а также биологическим равнове-сием и антагонистическим взаимодействием патогенной, условно-патогенной и непатогенной микрофлоры [4]. Изменение структуры рогового слоя приводит к повышению проницаемости кожи для грибов и бактерий [22]. Сдвиг показателей pH эпидермиса в щелочную сторону приводит к усилению десквамации корнеоцитов, нарушению процессов формирования ламеллярных телец, вызывает истончение кожи и замедляет восстановление кожного барьера. В целом поствоспалительный дефицит эпидермального барьера может быть обусловлен дефицитом инволюкрина, приводящим к нарушению когезии корнеоцитов; недостатком натуральных увлажняющих факторов, способствующих дегидратации, и липидов рогового слоя; генетически детерминированным дефицитом филаггрина [23]. Микробные аллергены обладают выраженной антигенной активностью, вызывают и поддерживают иммунное воспаление. Нарушение целостности кожного покрова при его расчесывании вследствие зуда формирует входные ворота для инфекции. Экссудация, сопровождающая экзему, способствует концентрации белков на поверхности кожи и создает благоприятные условия для размножения вторичной инфекции [4].
Состояние микробиоты кожи у больных микробной экземой. В последние годы все больше внимания уделяют изучению состояния микробиоты кожи у больных МЭ [21, 24—26]. У здорового человека микрофлора принимает участие в реализации защитной функции кожи путем подавления патогенных микроорганизмов непатогенными [27]. Видовые и количественные изменения состава нормальной микрофлоры кожи могут сопровождаться как развитием заболевания, так и манифестацией болезней, протекающих субклинически [28, 29].
В соскобах пораженного эпидермиса у больных МЭ в Москве в 80% случаев высевается Staphy-lococcus aureus, в 14% — S. haemolyticus, в 40,7% — нелипофильные дрожжевые грибы, преимущественно рода Candida spp. [24]. В исследовании, выполненном спустя 10 лет в Москве, также установлено преобладание грамположительной кокковой микробиоты, представленной в основном Staphylococcus spp. (64,3%) и Streptococcus spp. (33,3%) [21]. Авторы также установили наличие в носоглотке S. aureus (33,3%), Klebsiella pneumoniae (19,8%), Proteus vulgaris (16,7%). Инфекционные патогены с более низкой частотой высевались также в отделяемом урогенитального тракта и при исследовании кала на дисбактериоз. На преобладание кокковой микрофлоры в очагах поражения при МЭ свидетельствуют результаты исследований, выполненные в Самаре [25]. Стафилококки высеяны у 96,7% больных. Их видовой состав был представлен: S. aureus (65%), S. epidermidis (43,3%), S. saprophytes (3,3%). У 13,4% больных был высеян Streptococcus pyogenes. В единичных случаях верифицировались Propionibacterium, Corinebacterium (по 5%) и E. coli, Proteus, Klebsiella (по 3,3%). Существенно, что в 2/3 (66,7%) случаев зарегистрирован рост монокультуры, а в 1/3 (33,3%) — ассоциации 2—3 микроорганизмов. У больных МЭ, обследованных в Казани, в острой стадии заболевания и при обострении хронического процесса в очагах поражения преобладал S. aureus (1535,6±41,8 и 1682,2±52,6 КОЕ/мл соответственно). На внешне не измененной коже его популяция была значительно меньше (403,0±36,4 и 515,8±61,0 КОЕ/мл) [11].
Количественные отличия видового состава возбудителей микробиоты кожи у больных МЭ при остром и хроническом течении заболевания выявлены при сравнении со здоровыми людьми [26]. Уровень общей плотности микроорганизмов на воспаленных участках кожи при остром течении процесса был в 38 раз выше, чем на внешне не измененной коже (1562±14,9 КОЕ/см 2 против 41,2±6,1 КОЕ/см 2 ); при хроническом течении заболевания этот показатель отличался в 21 раз (1562±14,9 КОЕ/см 2 против 75,2±8,2 КОЕ/см 2 ). По сравнению со здоровыми лицами (3,6±0,5 КОЕ/см 2 ) различия составляли уже в 434 и в 20,9 раза соответственно. В структуре микробиоты резко преобладали грамположительные микроорганизмы, плотность которых в очагах поражения при остром процессе была 10 раз выше, чем при хроническом (221,2±2,0 КОЕ/см 2 против 22,0±4,1 КОЕ/см 2 ) и достоверно выше, чем у этих же пациентов на неизмененной коже (132,1±1,4 и 14,7±0,2 КОЕ/см 2 соответственно). А при сравнении со здоровыми людьми (0,7±0,1 КОЕ/см 2 ) этот показатель отличался в 315,7 и 34,4 раза соответственно. Общая плотность возбудителей рода Staphylococcus spp. при остром процессе на пораженных участках кожного покрова составляла 37,1±2,6 что было достоверно выше, чем на внешне не измененной коже (24,8±2,9 и 16,1±1,8 КОЕ/см 2 соответственно). По сравнению со здоровыми лицами, при МЭ в очагах поражения эти показатели были в17,7 и 11,2 раза выше. В то же время плотность дрожжеподобных грибов рода Candida spp. была выше при хронической МЭ по сравнению с острой (5,7±0,4 КОЕ/см 2 против 3,1±0,2 КОЕ/см 2 ) и отличалась в 28,5 и 15,5 раза по сравнению с таковой у здоровых лиц (0,2±0,01 КОЕ/см 2 ). При хроническом процессе обсемененность пораженных и внешне не измененных участков кожного покрова Candida spp. была практически идентичной.
Иммуноаллергическая концепция развития микробной экземы. Ведущими в патогенезе МЭ являются инфекционные аллергены — бактериальные, вирусные, грибковые, протозойные и др. [12, 30—33]. Провоцировать заболевание могут также экзогенные раздражители — физические, механические и биологические. Иммуноаллергическая теория наглядно подтверждается эмпирически выявленной стадийностью течения М.Э. Первоначально заболевание развивается в виде экзематизации на месте неаллергических банальных пиодермитов, а затем через экзематиды и локализованные формы трансформируется в генерализованный процесс [34, 35]. Очаги М.Э. часто возникают на местах длительно персистирующей пиодермии (рис. 2) и вокруг гнойных ран (рис. 3, а, б, в), при расчесывании скабиозной лимфоплазии кожи (рис. 4) [34, 36—38]. МЭ является осложнением дерматофитий крупных складок и стоп (рис. 5), поверхностного кандидоза кожи (рис. 6), развивается на фоне варикозного симптомокомплекса [9, 39—41] (рис. 7). Первоначально сенсибилизация может носить моновалентный характер, но со временем становится поливалентной [3]. Схема патогенеза МЭ представлена на рис. 8.
 Рис. 2. Микробная экзема на месте персистирующего стафилококкового импетиго.
Рис. 2. Микробная экзема на месте персистирующего стафилококкового импетиго.
 Рис. 3. Паратравматическая микробная экзема. а — на месте внутримышечного введения хлористого кальция; б — на месте термического ожога; в — вокруг свищевого отверстия при остеомиелите.
Рис. 3. Паратравматическая микробная экзема. а — на месте внутримышечного введения хлористого кальция; б — на месте термического ожога; в — вокруг свищевого отверстия при остеомиелите.
 Рис. 4. Микробная экзема на месте скабиозной лимфоплазии кожи в области локтя.
Рис. 4. Микробная экзема на месте скабиозной лимфоплазии кожи в области локтя.
 Рис. 5. Микотическая экзема, осложнившая дерматофитию крупных складок и стоп.
Рис. 5. Микотическая экзема, осложнившая дерматофитию крупных складок и стоп.
 Рис. 6. Микотическая экзема, осложнившая поверхностный кандидоз кожи (отсутствие эпонихия — диагностически значимый симптом).
Рис. 6. Микотическая экзема, осложнившая поверхностный кандидоз кожи (отсутствие эпонихия — диагностически значимый симптом).
 Рис. 7. Варикозная экзема (а, б), сочетание варикозной и микотической экзем (в).
Рис. 7. Варикозная экзема (а, б), сочетание варикозной и микотической экзем (в).
 Рис. 8. Схема патогенеза микробной экземы.
Рис. 8. Схема патогенеза микробной экземы.
В патогенезе МЭ решающая роль отведена бактериальной сенсибилизации при ведущей роли S. аureus и St. hemolyticus [30, 41, 42]. Сенсибилизация к указанным аллергенам характеризуется возрастанием частоты и выраженности гиперергической реакции немедленного типа (ГНТ) и снижением этих показателей для гиперэргической реакции замедленного типа (ГЗТ). С одной стороны, не исключена возможность активации МЭ за счет персистенции бактериальной микрофлоры в очагах хронической инфекции в других органах и системах организма (носоглотка, миндалины, желудочно-кишечный тракт, гепатобилиарная система, репродуктивная система и т. д.). Очаги хронической инфекции имеют место у 65,3% больных МЭ [30]. С другой стороны, наличие у больных МЭ дефицита клеточного и гуморального звеньев иммунитета способствует формированию очагов хронической инфекции и персистенции на коже преимущественно патогенных микроорганизмов [43].
Полученные данные являются наглядным доказательством необходимости использования при МЭ топических препаратов, обладающих широким спектром антимикробной активности.
При комплексной оценке иммунологических нарушений при МЭ выявлено изменение многих показателей клеточного, гуморального и цитокинового звеньев иммунного ответа (табл. 1).
 Таблица 1. Изменение показателей иммунного статуса у больных МЭ
Таблица 1. Изменение показателей иммунного статуса у больных МЭ
У пациентов с МЭ развивается иммунологически обусловленный латентно протекающий синдром эндогенной интоксикации, проявляющийся клинически в виде комплекса неспецифических симптомов. Повышение концентрации циркулирующих иммунных комплексов (ЦИК) и величины лейкоцитарного индекса интоксикации (ЛИИ) прямо пропорционально напряженности иммунопатологических процессов. Клиническая форма МЭ, распространенность высыпаний, продолжительность обострения находятся в прямой зависимости от выраженности иммунологических сдвигов и эндотоксикоза. Ключевым показателем эндотоксикоза является содержание IgG, IgG2 в кровяном русле. Снижение экспрессии TLR2, TLR4 и TLR9 на клетках крови наблюдается по мере увеличения тяжести заболевания, что зачастую сопровождается развитием клинически тяжелых форм дерматоза. Снижение уровня антимикробных пептидов в сыворотке крови больных коррелирует с длительностью и тяжестью экзематозного процесса. При остром процессе происходит повышение уровня CD14+DR+ моноцитов, а в период обострения хронического процесса — их снижение. Повышение концентрации IL-2 свидетельствует об активном островоспалительном процессе. Повышение уровня IL-17 и γ-интерферона (IFN-γ) связано с развитием аллергического воспаления и защитой от инфекции. IFN-γ обеспечивает запуск цитокинового каскада, направленного на формирование очага воспаления с привлечением эффекторных клеток. Снижение уровня лактоферрина в сыворотке крови свидетельствует об активации бактериальной инфекции.
Данные исследования свидетельствуют, что для топической терапии МЭ следует использовать препараты с выраженным противовоспалительным эффектом. К этим препаратам относятся топические кортикостероиды (ТКС), которые заняли одно из ведущих мест в лечении стероидочувствительных заболеваний кожи. В настоящее время дерматологи назначают их в 3,9 раза чаще, чем врачи других специальностей. МЭ относится к группе дерматозов, при которых терапия ТКС патогенетически обоснована и используется в комплексе с препаратами других групп. ТКС — это этиотропная и патогенетическая терапия в случаях, когда основой заболевания является воспаление в коже, особенно иммуноопосредованное. ТКС обладают противовоспалительным, противоаллергическим, вазоконстрикторным и иммуносупрессивным эффектом. Они регулируют иммунный ответ путем снижения количества лимфоцитов, угнетения Т-лимфоцитов, усиления апоптоза Т- и В-лимфоцитов, торможения образования иммунных комплексов и снижения активности системы комплемента. Это приводит к торможению гиперреакции иммунной системы при контакте с антигеном. В то же время без локальной и контролируемой извне иммуносупрессии невозможно добиться необходимой эффективности препарата по отношению к гипериммунным аллергодерматозам. С другой стороны, наличие иммуносупрессивного действия исключает возможность применения однокомпонентных ТКС в терапии дерматозов, сочетающихся с инфекционными патологическими процессами. В сравнении с традиционными средствами для наружной терапии ТКС обладают существенными преимуществами и подавляют все основные компоненты аллергического воспаления. Инфекционный процесс следует купировать путем назначения комбинированных ТКС. С учетом биоритма продукции кортизола в организме и ритма эпидермальной пролиферации ТКС для усиления противовоспалительного эффекта следует применять в утренние часы, а для антипролиферативного эффекта — вечером [23].
Роль дрожжеподобных грибов рода Candida spp. в патогенезе микробной экземы. Помимо бактериальных инфекций при аллергических заболеваниях причинно-значимыми аллергенами могут быть дрожжеподобные грибы рода Candida spp. [3, 45—47]. Широкое применение антибиотиков, кортикостероидов, гормональных контрацептивов способствовало трактовке кандидоза как одного из серьезных инфекционных осложнений медикаментозной терапии [48, 49]. При М.Э. антибиотики составляют основу традиционных схем лечения, нередко в виде повторных курсов [10, 50]. Поводами для назначения антибиотиков больным МЭ являются традиционные схемы лечения, санация очагов хронической бактериальной инфекции в различных органах и вторичной пиодермии на коже. Кандидоз кожи и слизистых оболочек как инфекционные осложнения антибактериальной терапии в нашей практике зарегистрированы у 85% больных МЭ [42]. Такая высокая частота обусловлена тем, что на консультативный прием к профессору обращались пациенты, которые длительное время получали традиционную терапию, в том числе неоднократные курсы антибиотикотерапии различными препаратами без антимикотической поддержки. Осложнения от применения антибиотиков многочисленны и влияют на течение МЭ [1].
Дрожжеподобные грибы рода Candida spp. относятся к условно-патогенным микроорганизмам и могут индуцировать формирование ГНТ у 62,3—78% пациентов с МЭ [30, 33]. Методом постановки кожных аллергических проб показано, что у больных МЭ отмечается изменение кожной реактивности к S. aureus, St. hemolyticus, C. albicans. Возрастает частота и увеличение размеров волдыря при ГНТ и снижение частоты и средних размеров папулы при ГЗТ [30, 41]. Микромицеты Candida spp., являясь типичными возбудителями оппортунистических инфекций, проявляют свой патогенный потенциал при условии нарушений в системе антимикробной резистентности хозяина. Они осложняют основной патологический процесс, являясь причиной резистентности к терапии и лекарственной непереносимости [48].
Аллергизирующее действие S. аureus и C. albicans при МЭ значительно усиливаются в условиях микст-инфекции. Клинически и экспериментально доказан синергизм бактериальной и дрожжевой микрофлоры при различных патологических состояниях и при МЭ [41, 51, 52]. Возбудители бактериальной микрофлоры при ассоциированной инфекции чаще характеризуются антибиотикорезистентностью, лизоцимной, адгезивной, гемолитической, лецителлазной, ДНК активностями [52]. Колонизация зева и носа одновременно S. aureus и Candida spp. при МЭ приводит к более тяжелому течению заболевания и хронизации процесса. Индекс оценки тяжести МЭ при наличии кандидоза достоверно выше, чем при его отсутствии (23,4±7,7 балла против 13,1±4,4 балла). Непрерывное течение заболевания регистрируется в 2,2 раза чаще, нередко (23%) появляются кандидамикиды [42]. Антительный ответ в виде специфических IgM-антител и IgG-антител на C. albicans регистрируется у 81,2% больных. Отсутствие в сыворотке крови больных МЭ антигена маннана — основного белка клеточной станки C. albicans — является прямым доказательством наличия неинвазивного кандидоза и обосновывает целесообразность использования топических антимикотиков [33].
Полученные данные указывают на целесообразность при рецидивирующем и непрерывном течении МЭ проводить обследование больных на наличие дрожжеподобных грибов рода Candida spp., используя для этой цели клинические и лабораторные данные (рис. 9). При обнаружении Candida spp. следует проводить специфическую терапию c использованием комбинированных препаратов с антимикотиками, а при их отсутствии — курс профилактической терапии.
 Рис. 9. Схема обследования больного микробной экземой для выявления поверхностного кандидоза кожи и/или слизистых оболочек
Рис. 9. Схема обследования больного микробной экземой для выявления поверхностного кандидоза кожи и/или слизистых оболочек
Диагностика МЭ основывается на данных анамнеза и клинической картины заболевания. По показаниям и с целью проведения дифференциальной диагностики назначают лабораторные исследования. Наиболее значимы клинический анализ крови, иммуноферментный анализ (ИФА) для определения антител к антигенам дрожжеподобных грибов рода Candida spp., лямблий, аскарид, описторхий, токсокар и других. При подозрении на кандидоз первоначально проводят бактериоскопическое исследование отделяемого зева, носа и гениталий на наличие псевдомицелия. Его наличие — ключевой механизм патогенеза кандидоза. Желательно проводить культуральное исследование отделяемого соскобов с очагов поражения на коже, отделяемого зева, носа, гениталий для идентификации бактериальной микрофлоры, дрожжевой микрофлоры и определения ее чувствительности к антибактериальным и антимикотическим препаратам.
Общие принципы лечения микробной экземы
Выбор тактики лечения МЭ строится с учетом многих факторов. К ним относятся этиопатогенез заболевания, тяжесть его течения, острота процесса, сопутствующая соматическая патология, наличие очагов хронической инфекции, триггерных факторов, предшествующая терапия и ее эффективность, анализ результатов лабораторного обследования, в том числе иммунологические показатели, особенно при тяжелом течении заболевания. Тактика лечения индивидуальна для каждого больного.
Для оценки тяжести процесса используют индекс оценки тяжести МЭ (ИОТМЭ) [53, 54]. Он определяется суммой баллов по шести клиническим параметрам заболевания (эритема, мокнутие, инфильтрация, импетигинизация, увеличение лимфатических узлов и площадь очагов поражения). В соответствии с показателями ИОТМЭ условно выделены три степени тяжести заболевания: легкая (до 15 баллов), средняя (16—25) и тяжелая (более 25), что следует учитывать при выборе системной терапии. В основе выбора тактики наружной терапии лежит оценка остроты процесса: острый, подострый и хронический (рис. 10).
 Рис. 10. Тактика лечения больных микробной экземой.
Рис. 10. Тактика лечения больных микробной экземой.
При первичном эпизоде МЭ и ее легком течении системная терапия может быть ограничена антигистаминными препаратами (табл. 2).
 Таблица 2. Антигистаминные препараты [10]
Таблица 2. Антигистаминные препараты [10]
При выраженном кожном зуде дополнительно назначают транквилизатор с антигистаминным действием гидроксизин по 25 мг 2—4 раза в сутки пер-орально в течение 3—4 нед [10, 55]. При наличии выраженной экссудации и распространенном процессе показана детоксикационная терапия. С этой целью можно использовать натрия хлорид, реамберин (натрия хлорид + меглюмина натрия сукцинат + калия хлорид + натрия гидроксид + магния хлорид) [10]. При распространенном и рецидивирующем процессах препаратами выбора являются системные кортикостероиды: бетаметазона дипропионат и бетаметазона натрия фосфат, преднизолон, дексаметазон [10]. Антибактериальные препараты показаны при средней и тяжелой степени МЭ, наличии очагов хронической инфекции, симптомов интоксикации (повышение температуры, озноб и т. п.), наличии сопутствующего лимфаденита (табл. 3).
 Таблица 3. Антибактериальные препараты [10]
Таблица 3. Антибактериальные препараты [10]
Обязательным условием при назначении системных глюкокортикостероидов и/или антибактериальных препаратов является назначение антимикотиков с учетом возможности развития кандидоза кожи и/или слизистых оболочек. В Федеральных клинических рекомендациях (2013) не отражен перечень лекарственных препаратов, воздействующих на клеточное, гуморальное, цитокиновое звенья иммунитета. Это дает возможность специалистам самостоятельно решать данную проблему с учетом результатов иммунологического обследования пациентов.
Наружная терапия МЭ проводится в соответствии с классическими канонами дерматологии. При остром процессе показаны примочки (танин, борная кислота, нитрат серебра, перманганат калия и др.), аэрозоли, водная взбалтываемая смесь (циндол), присыпки, лосьоны, анилиновые красители (бриллиантовый зеленый, фукорцин, метиленовый синий), антисептики (хлоргексидина биглюконат) [10]. При подостром процессе препаратами выбора являются пасты (цинковая, Лассара) и комбинированные ТКС в виде крема. При хроническом процессе основой наружной терапии являются комбинированные ТКС в виде мази (табл. 4).
 Таблица 4. Комбинированные топические кортикостероиды [10]
Таблица 4. Комбинированные топические кортикостероиды [10]
При выявлении клинических симптомов поверхностного кандидоза кожи и/или слизистых оболочек следует назначать топические антимикотики. Их выбор базируется на наличии при МЭ неинвазивного кандидоза [41]. При верификации у больных кандидоза полости рта или гениталий считают, что источником вирулентных штаммов грибов является кишечник. Без адекватного подавления их кишечной популяции терапия кандидоза, как правило, бывает неудачной [56, 57]. Для лечения в такой ситуации необходим курс невсасывающихся противогрибковых препаратов. Общепризнанным топическим антимикотиком для кишечника является натамицин. Его назначают по 100 мг 4 раза в сутки курсом 7—10 дней. Для санации очагов микотической и бактериальной инфекции в носоглотке используют универсальный антисептик повидон-йод. Им полощут зев и промывают носовые ходы (20 капель на 1/3 стакана теплой воды) утром и вечером. Неизменным условием успешной терапии является соблюдение режима питания (рис. 11, 12) и выполнение мероприятий по предотвращению рецидивов заболевания (рис. 13).
 Рис. 11. Продукты, которые следует исключить из рациона больного микробной экземой, ассоциированной с поверхностным кандидозом кожи и/или слизистых оболочек.
Рис. 11. Продукты, которые следует исключить из рациона больного микробной экземой, ассоциированной с поверхностным кандидозом кожи и/или слизистых оболочек.
 Рис. 12. Продукты, которые следует использовать в рационе больного микробной экземой, ассоциированной с поверхностным кандидозом кожи и/или слизистых оболочек.
Рис. 12. Продукты, которые следует использовать в рационе больного микробной экземой, ассоциированной с поверхностным кандидозом кожи и/или слизистых оболочек.
 Рис. 13. Мероприятия для предотвращения рецидивов микробной экземы.
Рис. 13. Мероприятия для предотвращения рецидивов микробной экземы.
Для иллюстрации особенностей течения и выбора тактики лечения МЭ приводим два клинических случая из личной практики.
Больной Б., 36 лет, военнослужащий. Обратился на кафедру по рекомендации лечащего врача. Цель консультации: коррекция лечения. Жалуется на поражение кистей, высыпания на плечах, сопровождающиеся сильным зудом.
Данные анамнеза. Болеет более 1 года. Первоначально очаги поражения возникли в области концевых фаланг II—III пальцев правой кисти. Лечился самостоятельно триамцинолона ацетонидом (фторокорт). Отмечалось временное незначительное улучшение. За 3 мес процесс распространился на все пальцы, ладонь и запястье. Обратился к дерматологу по месту жительства. Диагностирована истинная экзема. Назначены хлоропирамина гидрохлорид (супрастин) по 1 таблетке на ночь, глюконат кальция по 1 таблетке 3 раза в день. Местно — примочки со слабым раствором перманганата калия, туширование дефектов кожи фукорцином, смазывание очагов поражения кремом мометазона фуроат вечером. Эффект от лечения незначительный. Начали появляться очаги поражения на плечах.
Больной — любитель пива. В рационе преобладает белый хлеб, дрожжевая выпечка, часто употребляет сладости. Около 6 мес назад лечился по поводу кандидозного баланопостита кремом клотримазол. В течение года 2 раза перенес простудные заболевания. В связи с этим получал цефазолин в течение 1 нед.
Данные объективного осмотра. Процесс диссеминированный. Кожа пальцев обеих кистей гиперемирована, шелушится, имеются серозные корочки. Сильно поражены концевые фаланги пальцев: отмечаются отечность, гиперемия, мокнутие, серозно-гнойные корочки. Отечны околоногтевые валики I—III пальцев, здесь же отсутствует эпонихий (рис. 14, а). На коже левого запястья с переходом на ладонь имеется очаг поражения правильной округлой формы диаметром 5 см в виде эритемы с серозно-гнойными корочками (см. рис. 14, б). На коже правого плеча два свежих очага округлой формы с четкими границами диаметром 1 и 2,5 см (см. рис. 14, в). Высыпания представлены эритемой, на фоне которой мелкие пустулы и мокнутие. На головке полового члена очаг гиперемии диаметром 2,5×3,0 см (см. рис. 14, г), в области венечной борозды отмечен небольшой налет серого цвета. Губки уретры отечны и гиперемированы.
 Рис. 14. Больной Б. с микробной экземой, ассоциированной с поверхностным кандидозом кожи. а — очаги поражения: на кистях — отсутствует эпонихий на I—III пальцах; б — на запястье с переходом на ладонь; в — на предплечье; г — кандидозный баланопостит.
Рис. 14. Больной Б. с микробной экземой, ассоциированной с поверхностным кандидозом кожи. а — очаги поражения: на кистях — отсутствует эпонихий на I—III пальцах; б — на запястье с переходом на ладонь; в — на предплечье; г — кандидозный баланопостит.
Результаты лабораторного обследования. В общем анализе крови эозинофилия (8), СОЭ 14 мм/ч. Методом ИФА выявлен повышенный уровень IgM и IgG к C. albicans. При бактериологическом исследовании отделяемого зева выросли S. aureus и C. albicans, в материале из носа и уретры — только S. аureus. Бактериоскопически в зеве и в соскобе материала с головки полового члена обнаружены нити псевдомицелия. При бактериологическом исследовании кала выявлено снижение бифидумбактерий (10 4 КОЕ/г), повышенное содержание S. aureus (10 5 КОЕ/г) и С. albicans (10 5 КОЕ/г).
Окончательный диагноз: микробная (микотическая) экзема, стадия обострения, рецидивирующее течение. Поверхностный кандидоз кожи (онихии, баланопостит) и слизистой оболочки полости рта. Дисбиоз кишечника с повышенной пролиферацией С. albicans.
Назначено лечение: натамицин по 100 мг 4 раза в день после еды, курсом 7 дней. Антигистаминный препарат левоцетиризина дигидрохлорид по 1 таблетке на ночь, курсом 14 дней. Рибофлавин 8 мг в сутки, курсом до 1 мес.
Наружная терапия: околоногтевые валики, концевые фаланги I—III пальцев и очаги на плече смазывать утром фукорцином, а на ночь — кремом, содержащим бетаметазона дипропионат + клотримазол + гентамицин (Акридерм ГК) (рис. 15) в течение 2—3 дней до подсыхания экссудата. Затем крем применять утром и вечером еще 2 нед. В очаг на запястье изначально втирать крем 2 раза в сутки. Головку полового члена и внутренний листок крайней плоти ополаскивать на ночь розовым раствором перманганата калия, тщательно высушивать бумажной салфеткой и втирать Акридерм ГК. Полоскать полость рта и промывать носовые ходы раствором повидон-йода из расчета 30 капель на 1/3 стакана теплой воды — курс 14 дней.
 Рис. 15. Информация о препарате, содержащем бетаметазона дипропионат + клотримазол + гентамицин (Акридерм ГК).
Рис. 15. Информация о препарате, содержащем бетаметазона дипропионат + клотримазол + гентамицин (Акридерм ГК).
Оценка эффективности терапии. Через 1 нед разрешился баланопостит. На месте очага в области запястья осталось розовое пятно. Значительное улучшение процесса зарегистрировано в области кистей и плеча. Через 2 нед полностью исчезли очаги на плече. Кожа кистей оставалась слегка гиперемированной и сухой. Назначен эмолентный крем 2—3 раза в день. Рецидивов заболевания при наблюдении в течение 6 мес не зарегистрировано.
Больная М., 32 лет, направлена на консультацию дерматологом в связи с персистенцией кожных высыпаний после лечения чесотки. Женщина жалуется на наличие диссеминированных мелких высыпаний на туловище, конечностях и очаг поражения на левой молочной железе.
Данные анамнеза. Болеет 4 мес. Чесоткой за-разилась при уходе за отцом, у которого чесотка возникла на фоне Т-клеточной лимфомы кожи. Процесс носил распространенный характер. Первые признаки заболевания в виде зуда, усиливающегося в ночное время, и мелких везикул на боковых поверхностях пальцев у пациентки появились в октябре 2016 г. Обратилась в поликлинику, зак-репленную за местом работы. Поставлен диагноз: «Чесотка, подтвержденная лабораторно». Назначено лечение 5% концентратом перметрина в этаноле (медифоксом). Этим средством лечились сама больная и ее отец. Раствор втирали в 1-й и 4-й дни курса. Дома была проведена полноценная текущая дезинфекция. Однако спустя 2 нед у женщины возобновился зуд, и появились свежие высыпания на кистях, животе и в области молочной железы. Обратилась в частную клинику. Осмотрена профессором. Выявлены свежие чесоточные ходы на кистях. Лабораторно обнаружена живая самка чесоточного клеща. Поставлен диагноз: чесотка, скабиозная лимфоплазия кожи на молочной железе и ягодицах, рецидив заболевания. Причиной рецидива предположительно могла быть реинвазия от отца. Ей было назначено неадекватное лечение при распространенном процессе (два втирания медифокса) и наличии выраженной инфильтрации кожи за счет сопутствующего заболевания. Больной рекомендовано провести второй курс специфической терапии 20% эмульсией бензилбензоата, которую она втирала в 1-й и 4-й дни курса. Сильный зуд в области скабиозной лимфоплазии кожи (СЛК) создавал входные ворота для бактериальной инфекции, что привело к возникновению МЭ и аллергидов на отдаленных участках кожного покрова. Очаг поражения на молочной железе больная смазывала однокомпонентным ТКС — кремом мометазона фуроата. Расчесывание высыпаний (аллергиды) на коже туловища и конечностей привело к возникновению остиофолликулитов; зуд здесь уменьшился. Персистирование зуда способствовало нарушению психоэмоционального статуса пациентки. Она считала себя больной и не верила в выздоровление от чесотки.
Данные объективного осмотра. Процесс диссеминированный, но высыпания единичные. Основной очаг поражения локализуется в области молочной железы (рис. 16). Он захватывает сосок, ареолу молочной железы и на 0,5 см выходит за его пределы. Очаг представлен эритемой с инфильтрацией, тонкими чешуйко-корками и расчесами на поверхности. Границы четкие. Кисти, запястья, стопы, локти свободны от высыпаний. Чесоточные ходы отсутствуют. Симптомы Арди, Горчакова, Михаэлиса отрицательные. Выражена сухость кожных покровов.
 Рис. 16. Больная М. с микробной экземой соска и ареолы молочной железы (осложнение чесотки).
Рис. 16. Больная М. с микробной экземой соска и ареолы молочной железы (осложнение чесотки).
Результаты лабораторного обследования. Методом дерматоскопии обследованы кисти запястья, с
]]>